Како саставити реакциону једначину?
Реакције између различитих хемикалијаи елементи су један од главних предмета студија у хемији. Да би разумели како формулисати једначину реакције и користити их у сопствене сврхе, неопходно је имати довољно дубоко разумијевање свих регуларности у интеракцији супстанци, као и процесима са хемијским реакцијама.
Формулација једначина
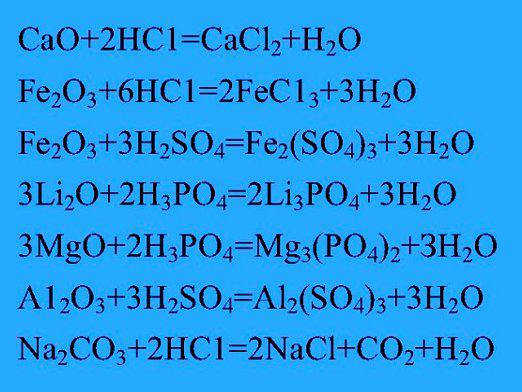
Један од начина изражавања хемијске реакцијеје хемијска једначина. Она бележи формулу првобитне супстанце и производа, коефицијенти који показују колико има молекула свака супстанца. Све познате хемијске реакције подељене су на четири типа: супституција, једињење, размена и распадање. Међу њима су: редокс, егзогена, јонска, реверзибилна, неповратна, итд.
Прочитајте више о томе како направити једначине хемијских реакција:
- Неопходно је одредити назив супстанци,у интеракцији једни са другима у реакцији. Напишите их на левој страни наше једначине. Као пример, размотрите хемијску реакцију која се формира између сумпорне киселине и алуминијума. Реагенси су на левој страни: Х2СО4 + Ал. Затим пишемо знак једнакости. У хемији можете да упознате знак "стрелица", која указује на десно, или супротно усмерене две стрелице, подразумевају "реверзибилност". Резултат интеракције метала и киселине је соли и водоник. Производи добијени након реакције требају се записати након ознаке "једнакости", тј. Са десне стране. Х2СО4 + Ал = Х2 + Ал2 (СО4) 3. Дакле, имамо дијаграм реакције.
- Да саставимо хемијску једначинупотребно је пронаћи коефицијенте. Вратимо се на претходну шему. Погледајмо га на левој страни. Сумпорна киселина садржи атоме водоника, кисеоника и сумпора, у приближном омјеру од 2: 4: 1. На десној страни налазе се 3 атома сумпора и 12 атома кисеоника у соли. Два атома водоника су садржана у молекулу гаса. Са леве стране, однос ових елемената је 2: 3: 12
- Изједначити број атома кисеоника исумпор, који у сулфату од алуминијума (ИИИ), потребно је ставити коефицијент 3 испред киселине испред једначине. Сада имамо 6 атома водоника са леве стране. Да би се изједначио број елемената водоника, потребно је ставити 3 пред водоник на десној страни једначине.
- Сада остаје само да се изједначи количина алуминијума. Пошто сол садржи два метална атома, поставили смо коефицијент 2 на левој страни испред алуминијума. Резултат је добијање реакционе једначине за ову шему: 2Ал + 3Х2СО4 = Ал2 (СО4) 3 + 3Х2
Пошто смо схватили основне принципе како формулисати једначину за реакцију хемијских супстанци, неће бити тешко касније написати било какву реакцију, чак и најекотичније, са становишта хемије.









